এইচএসসি রসায়ন ১ম পত্র সাজেশন ২০২৫
| উচ্চ মাধ্যমিক স্কুল সার্টিফিকেট (এইচএসসি) সুপার সাজেশন ২০২৫ বিজ্ঞান-মানবিক-বাণিজ্য বিভাগ এইচএসসি [ ২০২৫ এর সিলেবাস অনুযায়ী] রসায়ন ১ম পত্র (Chemistry 1st Paper) সুপার সাজেশন ২০২৫ subject code: 176 |
| ২০২৫ এর এইচএসসি ১০০% কমন সাজেশন |
এইচএসসি রসায়ন ১ম পত্র সাজেশন,রসায়ন ১ম পত্র এইচএসসি সাজেশন, চূড়ান্ত সাজেশন এইচএসসি রসায়ন ১ম পত্র, hsc রসায়ন ১ম পত্র সাজেশন pdf, এইচএসসি ১০০% কমন রসায়ন ১ম পত্র সাজেশন,
এইচএসসি পরীক্ষার সাজেশন ২০২৫ (PDF) লিংক
সর্বশেষ সংশোধিত ও সাজেশন টি আপডেটের করা হয়েছে ২০২৫
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
শিখনফল/বিষয়বস্তু
• পরমাণুর রাদারফোর্ড ও বাের মডেলের তুলনা করতে পারবে কোয়ান্টাম সংখ্যা, বিভিন্ন উপস্তর এবং ইলেকট্রন ধারণ ক্ষমতা ব্যাখ্যা করতে পারবে
• কোয়ান্টাম উপস্তরের শক্তিক্রম এবং আকৃতি বর্ণনা করতে পারবে
• আউফবাউ, হুন্ড ও পউলির বর্জন নীতি প্রয়োগ করে পরমাণুর ইলেকট্রন বিন্যাস করতে পারবে।
• তড়িৎ চুম্বকীয় বর্ণালী ব্যাখ্যা করতে পারবে
• বাের পরমাণুর মডেল অনুসারে হাইড্রোজেন পনমাণুর বর্ণালী ব্যাখ্যা করতে পারবে
নির্দেশনা:
১। ইলেকট্রন বিন্যাস সম্পর্কিত নীতিসমূহ ব্যাখ্যা করা।
২। কোয়ান্টাম সংখ্যা থেকে শক্তিস্তর সমূহের ইলেকট্রন ধারণ ক্ষমতা নির্ণয় করা।
৩। উপশক্তিস্তর সমূহের বর্ণনা ও আকৃতি ব্যাখ্যা করা।
৪। পারমাণবিক বর্ণালীর উৎস ব্যাখ্যা করা
উত্তর: লিংক
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস।
শিখনফল:
- পরমাণুর রাদারফোর্ড ও বোর মডেলের তুলনা করতে পারবে।
- কোয়ান্টাম সংখ্যা বিভিন্ন উপস্তর এবং ইলেকট্রন ধারণক্ষমতা ব্যাখ্যা করতে পারবে।
- কোয়ান্টাম উপস্তরের শক্তিক্রম এবং আকৃতির বর্ণনা করতে পারবে।
- আউফবাউ হুন্ড ও পাউলির বর্জন নীতি প্রয়োগ করে পরমাণুর ইলেকট্রন বিন্যাস করতে পারবে।
নির্দেশনা :
- পরমাণুর মডেল বর্ণনা করা।
- কোয়ান্টাম সংখ্যা সমূহ বর্ণনা করা।
- কোয়ান্টাম সংখ্যা থেকে পরমাণুর বিভিন্ন শক্তিস্তরে ইলেকট্রন ধারণ ক্ষমতা নির্ণয় করা।
- পরমাণুর উপশক্তিস্তরে ইলেকট্রন বিন্যাসের নীতি ব্যাখ্যা করা।
প্রশ্ন সমূহ:
ক) বোর পরমাণু মডেলের ব্যাখা নিম্নরূপ
খ)বোর পরমাণু মডেলের সীমাবদ্ধতাঃ
গ) n এর মান 3 হলে উক্ত শক্তিস্তরের মোট অরবিটাল সংখ্যা নির্ণয় এবং সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা হিসাব।
ঘ) আউফবাউ নীতি:
উত্তর: লিংক
রসায়ন ১ম পত্র এইচএসসি সাজেশন ২০২৫
১ম অধ্যায় ল্যাবরেটরির নিরাপদ ব্যবহার
- জিটেক্স গ্লাভস কি?
- মেজারিং সিলিন্ডার কি?
- 4 ডিজিট ব্যালেন্স কি?
- প্রমাণ দ্রবণ কি?
- মোলাল দ্রবণ কি?
- মোলারিটি কি?
- মোলালিটি কি?
- ওয়াশিং মিশ্রণ কি?
- দ্রবণ তাপ কি?
- প্রাইমারি স্ট্যান্ডার্ড পদার্থ কি?
- সেকেন্ডারি স্ট্যান্ডার্ড পদার্থ কাকে বলে
- নির্দেশক কি?
- নেসলার বিকারক কাকে বলে
- বিপদ সংকেত হ্যাজার্ড প্রতীক কি?
- ক্ষয়কারী পদার্থের সংজ্ঞা দাও
- সবুজ রসায়ন কি?
- লেডের বিষক্রিয়া কি?
দ্বিতীয় অধ্যায় গুনগত রসায়ন
- হাইজেনবার্গের অনিশ্চয়তা নীতি কি?
- প্রধান কোয়ান্টাম সংখ্যা কাকে বলে
- অরবিট কি?
- অরবিটাল সংকরণ কি?
- আউফবাউ নীতি কি?
- হুন্ডের নীতি কি?
- পলির বর্জন নীতি কি?
- বামার সংকেত কি?
- দ্রাব্যতা গুণফল কি?
- সম আয়ন প্রভাব কি?
- আংশিক পাতন কি?
- বাষ্প পাতন কাকে বলে
- উর্ধ্বপাতন কাকে বলে
- Rr কি?
তৃতীয় অধ্যায়ঃ মৌলের পর্যায়বৃত্ত ধর্ম ও রাসায়নিক বন্ধন
- ইলেকট্রন আসক্তি কাকে বলে
- তড়িৎ ঋণাত্মকতা কি?
- অবস্থান্তর মৌল কাকে বলে
- অসামঞ্জস্য বিক্রিয়া কাকে বলে
- উভধর্মী বিক্রিয়া কাকে বলে
- মৃৎক্ষার ধাতু কাকে বলে
- লিগ্যান্ড কি?
- পোলারায়ন কি?
- ফাজানের নীতি কি?
- জটিল যৌগ কি?
- অস্টক নীতি কি?
- ভ্যানডার ওয়ালস আকর্ষণ বল কি?
- হাইড্রোজেন বন্ধন কাকে বলে
- সিগমা বন্ধন কি?
চতুর্থ অধ্যায় রাসায়নিক পরিবর্তন
- গ্রিন কেমিস্ট্রি কে
- সক্রিয়ন শক্তি কাকে বলে
- লা শাতেলিয়ার নীতি বিবৃত করো
- রাসায়নিক সাম্যাবস্থা কি?
- বাফার দ্রবণ কি?
- অসমসত্ত্ব প্রভাবক কি?
- অটো প্রভাবক কাকে বলে
- ভর ক্রিয়ার সূত্রটি লিখ
- সাম্য ধ্রুবক কি?
- দ্রবণ তাপ কাকে বলে
- এটম ইকোনমি কাকে বলে
- হেশের সূত্রটি লিখ
পঞ্চম অধ্যায় কর্মমুখী রসায়ন
- খাদ্য নিরাপত্তা কি?
- বায়ুশূন্যকরণ কি?
- এনজাইম কি?
- BHA অর্থ কি?
- ফুড প্রিজারভেটিভ কি?
- স্টেরিলাইজার কাকে বলে
- সাসপেনশন কি?
- কোয়াগুলেশন কি?
- কলয়েড কি?
- পাস্তুরাইজেশন কি?
- টিনডাল প্রভাব কি?
- কার্বোহাইড্রেট কি?
- ভ্যানিশিং ক্রিম এর মূল উপাদান কি?
- মল্ট ভিনেগার কি?
| Honors Suggestion Links | প্রশ্ন সমাধান সমূহ |
| Degree Suggestion Links | BCS Exan Solution |
| HSC Suggestion Links | 2016 – 2025 জব পরীক্ষার প্রশ্ন উত্তর |
| SSC Suggestion Links | বিষয় ভিত্তিক জব পরিক্ষার সাজেশন |


রসায়ন ১ম পত্র এইচএসসি সুপার সাজেশন pdf download ২০২৫



pdf download রসায়ন ১ম পত্র এইচএসসি সুপার সাজেশন ২০২৫

[ বি:দ্র: উত্তর দাতা: রাকিব হোসেন সজল ©সর্বস্বত্ব সংরক্ষিত (বাংলা নিউজ এক্সপ্রেস)]
রসায়ন ১ম পত্র ২য় অধ্যায় সমাধান
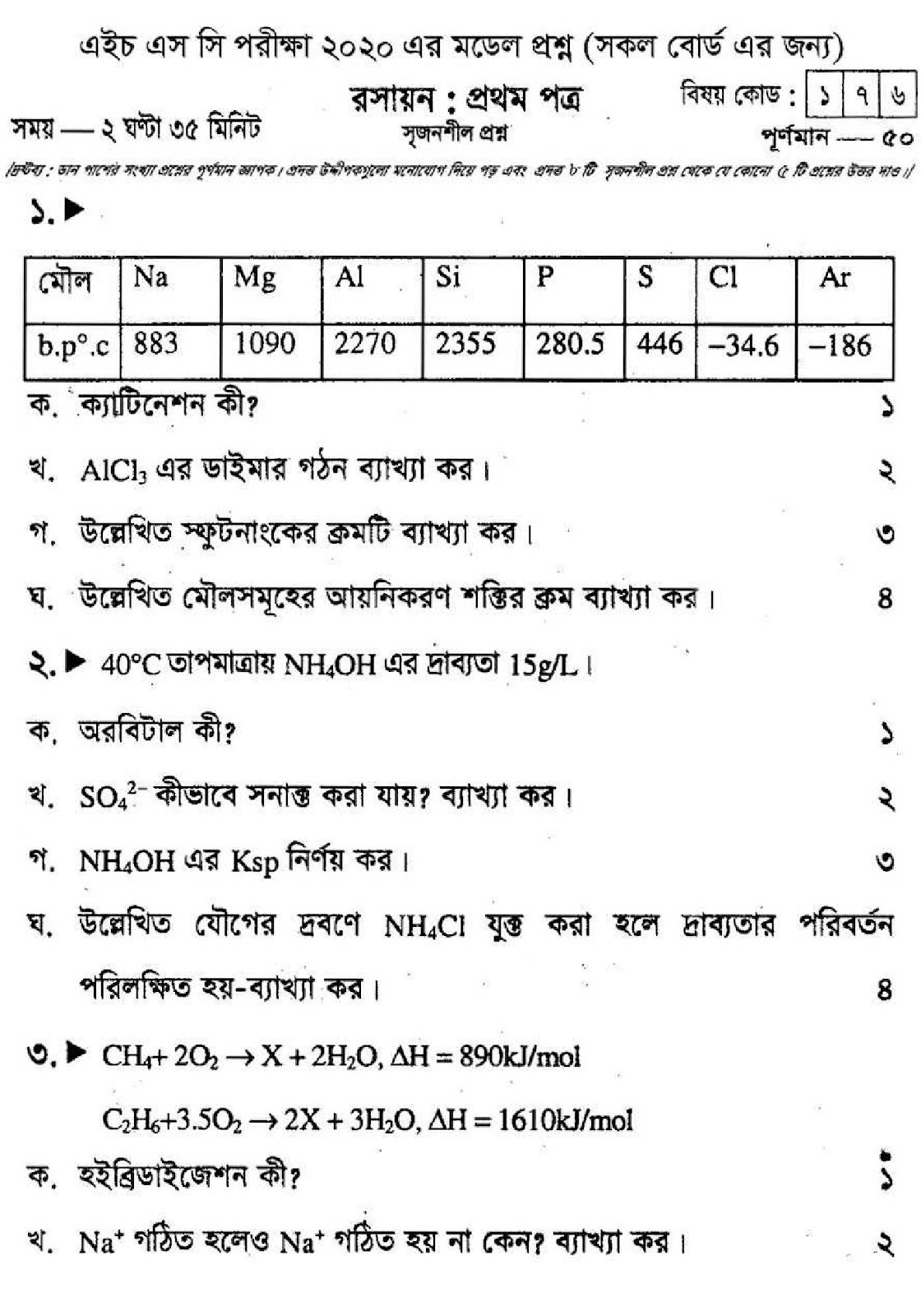
সৃজনশীল প্রশ্ন ১ : দুটি যৌগ A ও B এর জলীয় দ্রবণ K₄[Fe(CN)₆] এর সাথে যথাক্রমে গাঢ় নীল ও বাদামী বর্ণের অধঃক্ষেপ উৎপন্ন করে। A যৌগটি শিখা পরীক্ষায় কোনো বর্ণ সৃষ্টি না করলেও B যৌগ নীলাভ সবুজ বর্ণ সৃষ্টি করে।
ক. ক্রোমাটোগ্রাফি কী?
খ. Keএর মান অসীম হতে পারে না কেন?
গ. B যৌগটিতে কোন আয়ন উপস্থিত? বিক্রিয়াসহ লেখো।
ঘ. শিখা পরীক্ষায় A ও B এর মধ্যে ভিন্নতার কারণ বিশ্লেষণ করো।
সৃজনশীল প্রশ্ন ২ : A, B ও C তিনটি যৌগ যাদের স্ফুটনাংক যথাক্রমে 46°C, 78°C ও 100°CG
ক. মন্ট কী?
খ. ১ম গ্রুপের মৌলসমূহ সহজে দ্বিধনাত্মক আয়ন গঠন করে না- ব্যাখ্যা করো।
গ. B যৌগের বিশুদ্ধতা কীভাবে নির্ণয় করবে?
ঘ. A, B ও C যৌগের মিশ্রণ হতে উপাদানসমূহ বুদ অবস্থান পৃথকীকরণে কোন পদ্ধতি অধিকতর যুক্তিযুক্ত? বিশ্লেষণ করো।
সৃজনশীল প্রশ্ন ৩ : কোয়ান্টাম সংখ্যা আবিষ্কারের ফলে ইলেকট্রন তার নিজস্ব পরিচিতি লাভ করে । একটি ইলেকট্রন প্রধান কক্ষপথে আবর্তনের সময় নিজ অক্ষের ওপর কোন দিকে ঘুরতে থাকে তার সঠিক তথ্য কোয়ান্টাম সংখ্যার মাধ্যমে জানা যায়।
ক. রাইডার ধুবক কী?
খ. হুন্ডের নীতি ব্যাখ্যা করো।
গ. চারটি কোয়ান্টাম সংখ্যা সম্পর্কে সংক্ষেপে আলোচনা করো।
ঘ. 2d এবং 3ƒ সম্ভব নয় কিন্তু 3d এবং 4ƒ সম্ভব- এর যৌক্তিক কারণ উপস্থাপন করো।
সৃজনশীল প্রশ্ন ৪ : হাইড্রোজেন ছাড়া সব মৌলে ইলেকট্রন, প্রোটন ও নিউট্রন বিদ্যমান। M একটি মৌল যার ভর সংখ্যা 56 নিরপেক্ষ কণার সংখ্যা 30।
ক. সেমি মাইক্রো বিশ্লেষণ কী?
খ. বন্ধন সমযোজী বন্ধন ব্যাখ্যা করো।
গ. হুন্ডের নীতি অনুসারে M এর ইলেকট্রন বিন্যাস ব্যাখ্যা করো।
ঘ. কোয়ান্টাম সংখ্যার ধারণা থেকে M এর সর্বশেষ কক্ষপথে ইলেকট্রন সংখ্যা হিসাব করো।
সৃজনশীল প্রশ্ন ৫ : কালাচাঁদকে দুটি যৌগ, বোরন অক্সাইড এবং পটাসিয়াম হেক্সাসায়ানো আয়রন (II) এর কেন্দ্রীয় মৌলের ইলেকট্রনর বিন্যাস করতে বলায় সে নিম্নরূপ ইলেকট্রন বিন্যাস করল। (ইলেকট্রন বিন্যাসটি পিডিএফ ফাইলে)
ক. বর্ণালী কী?
খ. পানির আয়নিক গুণফল হতে কীভাবে pH স্কেল প্রতিষ্ঠিত হয়? ব্যাখ্যা কর।
গ. উদ্দীপকের অক্সাইড উভয়ধর্ম ব্যাখ্যা কর।
ঘ. কালাচাঁদের ইলেকট্রন বিন্যাসের যথার্থতা বিশ্লেষণ কর।
সৃজনশীল প্রশ্ন ৬ : X ও Y যথাক্রমে পর্যায় সারণীর ২য় ও ৩য় পর্যায়ের মৌল। উভয়ের যোজ্যতা স্তরে একটি করে ইলেকট্রন আছে।
ক. Hazard Symbol কী?
খ. ফ্লোরিন অপেক্ষা ক্লোরিনের ইলেকট্রন আসক্তি বেশি কেন?
গ. X এর চেয়ে Yএর কার্বনেটের স্থিতিশীলতা কম – ব্যাখ্যা কর।
ঘ. X ও Y মৌলের যোজ্যতা ইলেকট্রনের ৪ টি কোয়ান্টাম সংখ্যার তুলনামূলক আলোচনা কর।
সৃজনশীল প্রশ্ন ৭ : মিস আলফি কর্তৃক একটি সবুজ বর্ণের হাইড্রেটেড লবণ একটি দস্তার পাত্রে রেখে দেয়ার কিছুদিন পরে দেখা গেল যে, লবণটি বাদামী বর্ণে পরিণত হয়েছে। সেই সাথে জিংকের পাত্রটির অস্তিত্ব নাই।
ক. ইলেকট্রন বিন্যাস সম্পর্কিত হুন্ডের নিয়মটি বর্ণনাকর।
খ. সাম্যাংকের মান শূন্য বা অসীম হয় না- ব্যাখ্যা কর।
গ. লবণটি সংরক্ষণে আলফির পদ্ধতি উপযুক্ত নয় কেন? ব্যাখ্যা কর।
ঘ. জটিল যৌগ গঠনে কোন ধাতু প্যারা চৌম্বকত্ব প্রদর্শন করে? বিশ্লেষণ কর।
সৃজনশীল প্রশ্ন ৮ : X ও Z দুটি একই পর্যায়ের ক্রমিক ধাতব মৌল। Z মৌলের শেষ ইলেকট্রনের কোয়ান্টাম সংখ্যার সেট। (সেটটি পিডিএফ ফাইলে)
ক. অবস্থান্তর মৌল কী?
খ. পানির pH = 7 – ব্যাখ্যা কর।
গ. উদ্দীপকের মৌলের ইলেকট্রন বিন্যাস ব্যাখ্যা কর।
ঘ. উদ্দীপকের Z মৌলের ১৯ তম ও ২০ তম ইলেকট্রনের কোয়ান্টাম সংখ্যার সেট পলির বর্জন নীতি মেনে চলে – ব্যাখ্যা কর।
সৃজনশীল প্রশ্ন ৯ : Electron শক্তিপ্রাপ্ত হলে নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তরে যায় আবার শক্তি হারালে উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তরে ফিরে আসে । এ সময় পরমাণু বর্ণালী প্রদান করে।
ক. N.M.R কি?
খ. H-পরমাণুর ক্ষেত্রে ৭ম থেকে ২য় কক্ষপথে আসলে কতগুলো বর্ণালী রেখার সৃষ্টি হবে?
গ. n এর কোন মানের জন্য H-পরমাণুর বামার সিরিজের কোন রেখার তরঙ্গ দৈর্ঘ্য 434nm হবে।
ঘ. যদি M কক্ষপথ থেকে L কক্ষপথে H এর Electron স্থানান্তরিত হয়, তাহলে যে রেখা বর্ণালির সৃষ্টি হয় তার তরঙ্গ দৈর্ঘ্য ও বর্ণালি রেখার সংখ্যা নির্ণয় কর।
সৃজনশীল প্রশ্ন ১০ : একটি ব্যবহারিক পরীক্ষায় শিক্ষার্থীদের একটি লবণ দেয়া হলো যা শিখা পরীক্ষায় সবুজ শিখা দেয়। এর সঙ্গে শিক্ষার্থীদের A ও B দুটি যৌগের মিশ্রণ দেয়া হলো যাদের স্ফুটনাংক যথাক্রমে 78°C ও 98°C।
ক. কোয়াগুলেশন কী?
খ. “ফুড আ্যাডিটিত প্রিজার ভেটিভস নয়” ব্যাখ্যা কর।
গ. দ্রবণে লবণের ধনাত্মক আয়নটি কিভাবে সনাক্ত করবে? ব্যাখ্যা কর।
ঘ. A ও B যৌগের মিশ্রণ হতে উপাদান দুটি পৃথক করার প্রক্রিয়া আলোচনা কর।
২০২৫ রসায়ন ১ম পত্র এইচএসসি সাজেশন পিডিএফ ডাউনলোড
রসায়ন ১ম পত্র ৩য় অধ্যায় সমাধান
সৃজনশীল প্রশ্ন ১ : নিম্ন তাপমাত্রায় তরল পদার্থ জমাট বেঁধে কঠিন হলে তার ঘনত্ব বাড়ার কণা থাকলেও এক বিশেষ বন্ধনের উপস্থিতির কারণে তা ঘটে না। ফলে শীতপ্রধান দেশের সব জলাশয়ে জলজ প্রাণী বাঁচতে পারে। এছাড়াও তাদের বেঁচে থাকার পেছনে অপর এক প্রকার রাসায়নিক বন্ধন দায়ী।
ক. অরবিটালের সংকরণ কী?
খ. NaOH এবং HF – এর প্রশমন তাপের মান ধ্রুবক মানের চেয়ে বেশি কেন?
গ. উদ্দীপকে বর্ণিত তরলটির অনুস্থিদ একটি মৌলের যোজনী স্থির হলেও পর্যায় সারণির একই গ্রুপভুক্ত পরবর্তী মৌলের যোজনী পরিবর্তনশীল – ব্যাখ্যা করো।
ঘ. “সকল প্রকার জলজপ্রাণীর বেঁচে থাকার মূলেই রয়েছে উদ্দীপকের বন্ধনদ্বয়”__ বিষয়টির যৌক্তিক ব্যাখ্যা দাও।
সৃজনশীল প্রশ্ন ২ : A, B, R ও X এর পারমাণবিক সংখ্যা যথাক্রমে 11, 6, 17 ও 47। A, B ও X এর সাথে R আয়নিক ও সমযোজী যৌগ গঠন করে।
ক. হেসের সূত্র কী
খ. অবস্থান্তর মৌল রঙিন যৌগ গঠন করে কেন?
গ. B ও R দ্বারা গঠিত যৌগটির সংকরণ বর্ণনা করো।
ঘ. AR যৌগটি পানিতে দ্রবণীয় কিন্তু XR পানিতে অদ্রবণীয় – বিশ্লেষণ করো।
সৃজনশীল প্রশ্ন ৩ : Q, R ও T মৌলত্রয়ের পারমাণবিক সংখ্যা যথাক্রমে ৬, ৭ ও ১৫।
ক. সিগমা বন্ধন কী?
খ. H₂O তরল কিন্তু H₂S গ্যাসীয় – ব্যাখ্যা করো।
গ. Q ও R একই সংকরণ প্রদর্শন করলেও তাদের হাইড্রাইডের আকৃতি ভিন্ন – ব্যাখ্যা করো।
ঘ. ক্লোরিনের সাথে R একটি যৌগ গঠন করলেও T দুটি যৌগ গঠন করে – বিশ্লেষণ করো।
সৃজনশীল প্রশ্ন ৪ : পর্যায় সারণির দ্বিতীয় পর্যায়ের দুটি মৌল X এবং Y। এদের যোজনী স্তরের বিন্যাস যথাক্রমে ns²np³ এবং ns²np⁴।
ক. ল্যান্থানাইড কী? ১
খ. Kc এর মান শূন্য হয় না কেন?
গ. XH₃ এবং YH₂ এর বন্ধন কোণের তুলনা করো।
ঘ. XH₃ অপেক্ষা YH₂ শক্তিশালী এসিড – বিশ্লেষণ করো।
সৃজনশীল প্রশ্ন ৫ : C₂H₄, CH₄ NH₃ কতগুলো সমযোজী যৌগ ।
ক. অরবিটাল কী?
খ. শিখা পরীক্ষায় গাড় HCI ব্যবহৃত হয় কেন?
গ. উদ্দীপকের প্রথম যৌগটির অরবিটাল চিত্র অংকন করো এবং ঐ যৌগে কার্বনের সংকরীকরণ বর্ণনা করো।
ঘ. উদ্দীপকের শেষ দুটি যৌগে কার্বন ও নাইট্রোজেনের অরবিটাল সংকরীকরণ একই হলেও উহাদের অণুর আকৃতি ভিন্ন – মূল্যায়ন করো।
সৃজনশীল প্রশ্ন ৬ : W, X, Y ও Z মৌলসমূহের পারমাণবিক সংখ্যা যথাক্রমে 6, 14, 9, 17। মৌলের প্রতীকগুলো প্রচলিত প্রতীক নয়।
ক. ভর ক্রিয় সূত্র বিবৃত করো।
খ. CH₃ – COOH ও NaOH এর প্রশমন তাপ স্থির মান অপেক্ষা কম কেন?
গ. Yমৌলের ইলেকট্রন আসক্তি Z মৌল অপেক্ষা কম কেন?
ঘ. “WCl₄ আদ্র বিশ্লেষিত হয় না কিন্তু XCl₄ আদ্র বিশ্লেষিত হয়” মূল্যায়ন করো।
সৃজনশীল প্রশ্ন ৭ : Q ও R দুটি দ্বিতীয় পর্যায়ের ক্রমিক মৌল। Q এর শেষ শক্তিস্তরে তিনটি বিজোড় ইলেকট্রন বিদ্যমান। উভয় মৌল হাইড্রোজেনের সাথে বিক্রিয়া করে সাধারণ যৌগ A ও B গঠন করে।
ক. দ্রব্যতা কী?
খ. Fe²⁺ ও Fe³⁺ এর মধ্যে কোনটি স্থায়ী এবং কেন?
গ. B অপুর জ্যামিতির গঠন সংকরণের সাহায্য ব্যখ্যা কর।
ঘ. A এর সাথে H⁺ আয়ন সন্নিবেশ বন্ধন গঠন করলে সংকরণ ও জ্যামিতিক কাঠামোতে কোন পরিবর্তন কী? বিশ্লেষণ কর।
সৃজনশীল প্রশ্ন ৮ : AB₃ ও AB₅ যৌগ দুইটিতে বন্ধন ইলেকট্রন জোড় এর সংখ্যা যথাক্রমে ৩ ও ৫।
ক. সংকরায়ণ কাকে বলে?
খ. (H₂O)n এর মধ্যে কোন ধরনের বন্ধন বিদ্যমান, চিত্রের মাধ্যমে দেখাও।
গ. যদি AB₃ যৌগটিতে ৩ টি বন্ধন ইলেকট্রন জোড় ও দুইট নিঃসঙ্গ ইলেকট্রন জোড় বিদ্যমান থাকে, তবে তার সংকরায়ণসহ যৌগটির আকৃতি দেখাও।
ঘ. AB₅ যৌগটির সংকরায়ণ বর্ণনা করো এবং এ যৌগটির আকৃতি অংকন করে পাঁচটি কোণের মান লিখ।
সৃজনশীল প্রশ্ন ৯ : A ও B দুটি ধারাবাহিক দ্বিপরমাণুক মৌল । B মৌলটি অপেক্ষাকৃত সক্রিয়।
ক. মণ্ট কি?
খ. 2d অরবিটাল সম্ভব নয় কেন?
গ. A ও B মৌলদুটির আয়নিকরণ শক্তি ব্যাখ্যা করো।
ঘ. A ও B মৌলের হাই্রাইডের জ্যামিতিক আকৃতি ও স্ফুটনাঙ্ক আলোচনা কর।
সৃজনশীল প্রশ্ন ১০ : M ও N মৌলসমূহের পারমাণবিক সংখ্যা যথাক্রমে 6 ও 14। M মৌলটি হাইড্রোজেনের সাথে MH₄ যৌগ গঠন করলেও N মৌলটি তা করে না। অপরদিকে M ও N উভয়েই অক্সিজেনের সাথে ডাই অক্সাইড গঠন করে।
ক. নিকটোজেন কী?
খ. সোডিয়াম Na²⁺ আয়ন গঠন করে না কেন?
গ. MH₄ যৌগের আণবিক গঠন বর্ণনা করো।
ঘ. M ও N ডাই অক্সাইডের ভৌত অবস্থার ভিন্নতার কারণ বিশ্লেষণ করো।
মাধ্যমিক ও উচ্চমাধ্যমিক শিক্ষা বোর্ড ঢাকা, চট্টগ্রাম, কুমিল্লা, রাজশাহী, যশোর, বরিশাল,সিলেট দিনাজপুর,বাংলাদেশ কারিগরি শিক্ষা বোর্ড,মাদ্রাসা শিক্ষা বোর্ড, এর কমন সাজেশন ২০২৫
HSC /Alim Common Suggestion 2025
আজকের সাজেশস: ২০২৫ এইচএসসি রসায়ন ১ম পত্র পরীক্ষার সাজেশন, ২০২৫ এইচএসসি বর্ষ রসায়ন ১ম পত্র সাজেশন,
01. নিচের কোনটির জারণ ক্ষমতা সবচেয়ে বেশী?
উত্তরঃ ফ্লোরিন
02. ক্যাথোড রশ্মি কি?
উত্তরঃ ইলেকট্রন
03. মাতৃদুগ্ধ এর pH কত?
উত্তরঃ 6.6-6.9
04. নিন্মের কোনটির প্রোটন আসক্তি সবচেয়ে বেশী?
উত্তরঃ অ্যামোনিয়া
05. পর্যায় সারণিতে inner-transition মৌলের সংখ্যা-
উত্তরঃ 28
06. দুধের প্রধান খনিজ নয়-
উত্তরঃ সালফার
7. চোখে রক্তবর্ণ সৃষ্টির জন্য দায়ী কোনটি?
উত্তরঃ লিকার অ্যামোনিয়া
8. অব্যবহৃত লিথিয়াম অ্যালুমিনিয়াম হাইড্রাইট কে বিনষ্ট করতে কোনটি ব্যবহৃত হয়?
উত্তরঃ ম্যাগনেসিয়াম সালফেট
9. ক্রোমাটোগ্রাফিতে অনুসৃত হয়-
উত্তরঃ মাইক্রো বিশ্লেষণ
10. পানিতে মিশে পানির DO হ্রাস করে কোনটি?
উত্তরঃ প্রোপানোন
11. বেয়ার-ল্যাম্বার্ট সূত্রভিত্তিক হিসেব করা যায়?
উত্তরঃ মাইক্রো বিশ্লেষণ
12. বুনসেন বার্নারের বিজারণ মন্ডলে কোন গ্যাস থাকে?
উত্তরঃ কার্বন মনো-অক্সাইড
13. স্পিরিট ল্যাম্পের বৈশিষ্ট্য নয়-
উত্তরঃ উজ্জ্বল শিখা উৎপন্ন করে
14. কণিকেল ফ্লাস্ক সাধারণত কত আয়তনের হয়?
উত্তরঃ 250mL
15. মেজারিং সিলিন্ডারে সর্বনিম্ন কত mL মাপা যায়?
উত্তরঃ 1mL
16. যে কোনো ঘনমাত্রার প্রমাণ দ্রবণ তৈরিতে কোনটি ব্যবহৃত হয়?
উত্তরঃ মেজারিং ফ্লাস্ক
17. ক্ষতিকর রাসায়নিক উপাদানের গায়ে কোন প্রতীক থাকে?
উত্তরঃ Xn
18. কোন মৌলটির একটি মাত্র আইসোটোপ বিদ্যমান?
উত্তরঃ Au
19. সর্বমোট আবিস্কৃত আইসোটোপ এর সংখ্যা-
উত্তরঃ 1300
20. S অরবিটালের আকৃতি কিসের মতো?
উত্তরঃ ফুটবলের মতো
21. ক্যালসিয়াম আয়নের শিখা পরীক্ষায় কোবাল্ট ব্লু গ্লাসের মধ্য দিয়ে কোন বর্ণ দেখা যায়?
উত্তরঃ হালকা সবুজ
22. Frozen Shoulder এর চিকিৎসায় কোন রশ্মি ব্যবহৃত হয়?
উত্তরঃ Far-IR
23. নিচের কোন সিরিজটি তুলনামূলক ভিন্ন?
উত্তরঃ লাইমেন
24. কোন মৌলটি ইলেকট্রন বিন্যাসে সাধারণ নিয়মের ব্যতিক্রম দেখায়?
উত্তরঃ Au
25. ধানের তুষ থেকে ভোজ্যতেল নিষ্কাশন করা হয় কোন পদ্ধতিতে?
উত্তরঃ দ্রাবক নিষ্কাশন
26. লঘু তৈল থেকে বেনজিন কোন প্রক্রিয়ায় পৃথক করা হয়?
উত্তরঃ আংশিক পাতন
27. M শেল এর সর্বোচ্চ ইলেকট্রন ধারণা ক্ষমতা কত?
উত্তরঃ 18
28. রেলগাড়ির সার্চলাইটে কি ব্যবহার করা হয়?
উত্তরঃ ThO2
[ বি:দ্র: নমুনা উত্তর দাতা: রাকিব হোসেন সজল (বাংলা নিউজ এক্সপ্রেস)]
29. নিন্মের কোনটি কৃত্রিম তেজস্ক্রিয় মৌল নয়?
উত্তরঃ Fr
30. সক্সলেট নিষ্কাশনে কোন দ্রাবক ব্যবহার করা হয়?
উত্তরঃ পেট্রোল
31. শুষ্ক বরফের গলনাঙ্ক কত ডিগ্রি?
উত্তরঃ -৫৬°
32. লন্ডন বলের বন্ধন শক্তি কত?
উত্তরঃ 1-10 kJ/mol
33. অন্তঃআণবিক হাইড্রোজেন বন্ধন বিদ্যমান কোনটিতে?
উত্তরঃ অর্থো নাইট্রো ফেনল
34. ডাইপোল-ডাইপোল আকর্ষণ ঘটে-
উত্তরঃ পোলার
35. বিস্তারণ বা লন্ডন বলের উদাহরণ –
উত্তরঃ গোল্ড সাসপেনশন
36. মার্কিউরিক আয়োডাইট কোন বর্ণের হয়?
উত্তরঃ সাদা
37. গ্রিনার পদ্ধতির উদ্দেশ্য কি?
উত্তরঃ ক্লোরিন বর্জন
38. লেড প্রকোষ্ঠ পদ্ধতিতে সালফিউরিক এসিড উৎপাদনে কোনটি প্রভাবক হিসেবে কাজ করে?
উত্তরঃ NO
39. সালফিউরিক এসিড উৎপাদনের কোন ধাপটি তাপোৎপাদী?
উত্তরঃ সবগুলো
40. সালফিউরিক এসিড উৎপাদনের অত্যনুকুল চাপ কত?
উত্তরঃ 1.7 atm
41. নিচের কোনটি প্রাকৃতিক এন্টি-অক্সিডেন্ট নয়?
উত্তরঃ ভিটামিন এ
42. মাছের চর্বিতে কোন ভিটামিন থাকে?
উত্তরঃ ভিটামিন এ ও ডি
43. হারবাল ওয়েলের মূল উপাদান নয়-
উত্তরঃ কেনোলা তেল
44. কোল্ড ক্রিমের প্রলেপন এজেন্ট –
উত্তরঃ গ্লিসারিন
45. বিষাক্ত ধোঁয়া সৃষ্টিকারী রাসায়নিক বিক্রিয়ার সময় কী করব উচিত নয়-
উত্তরঃ কন্ট্যাক্ট লেন্স পড়া
46. এসিড লঘুকরণে কোনটি ব্যবহার করা উচিত?
উত্তরঃ ফিউম হুড
47. হাইড্রোজেন পার-অক্সাইডের শরীরে প্রভাব-
উত্তরঃ ত্বকের ক্ষতি
48. কার্বনের কতটি স্তায়ী আইসোটোপ বিদ্যমান?
উত্তরঃ ২
49. কোন অরবিটালের জন্য হুন্ডের নিয়ম প্রযোজ্য নয়?
উত্তরঃ s
50. কত সেলসিয়াস তাপমাত্রায় গ্লুবার লবণ নিরুদিত হয়?
উত্তরঃ 32.4°C
১. s–ব্লকের মৌলসংখ্যা কত?
ক. ১৪ খ. ২৪
গ. ২৬ ঘ. ৩৬
২. p–ব্লকের মৌলসংখ্যা কত?
ক. ১৪ খ. ৩৬
গ. ৪১ ঘ. ২৭
৩. d–ব্লকের মৌলসংখ্যা কত?
ক. ১৪ খ. ৩৬
গ. ৪১ ঘ. ২৭
৪. কোনো মৌলের পরমাণুর যোজ্যতাস্তরে ns2np5 ইলেকট্রন বিন্যাস থাকলে ওই মৌলের অবস্থান পর্যায় সারণিতে কোন গ্রুপে হবে?
ক. 15 (5A) খ. 5 (5B)
গ. 17 (7A) ঘ. 2 (2A)
৫. পর্যায় সারণিতে একই পর্যায়ে বাঁ থেকে ডান দিকের মৌলগুলোর ক্ষেত্রে কোন তথ্যটি সঠিক?
ক. আয়নীকরণ শক্তি বৃদ্ধি পায়
খ. ইলেকট্রন আসক্তি হ্রাস পায়
গ. তড়িৎ ঋণাত্মকতা অপরিবর্তিত থাকে
ঘ. পরমাণুর আকার বাড়তে থাকে
৬. ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হতে যে শক্তির প্রয়োজন হয়, তাকে কী বলে?
ক. ইলেকট্রন আসক্তি
খ. তড়িৎ ঋণাত্মকতা
গ. আয়নিক পটেনশিয়াল
ঘ. আয়নীকরণ শক্তিবিজ্ঞাপন
৭. আয়ন রঙিন হয়—
i. বহিঃস্তরের ইলেকট্রনের ধাপান্তর ঘটলে
ii. বহিঃস্তরে অপূর্ণ d অরবিটাল থাকলে
iii. ইলেকট্রন বিন্যাস [Ar] ns2 (n–1)d o হলে
নিচের কোনটি সঠিক?
ক. i ও ii খ. i ও iii
গ. ii ও iii ঘ. i, ii ও iii
৮. SiO2 কোন ধর্মী অক্সাইড?
ক. অম্লীয় খ. ক্ষারীয়
গ. উভধর্মী ঘ. নিরপেক্ষ
৯. NCl3 অণুর আকৃতি কী রূপ?
ক. ত্রিভুজাকার খ. পিরামিডীয়
গ. চতুস্তলকীয় ঘ. কৌণিক
১০. তৃতীয় পর্যায়ের প্রথম চারটি মৌলের কোন ধর্মটি ক্রমাগত বৃদ্ধি পায়?
ক. পারমাণবিক ব্যাসার্ধ
খ. আয়নীকরণ শক্তি
গ. মৌলের গলনাঙ্ক
ঘ. ধাতব ধর্ম
১১. কোনটির আয়নীকরণ শক্তি বেশি?
ক. কার্বন খ. নাইট্রোজেন
গ. অক্সিজেন ঘ. ফসফরাস
সঠিক উত্তর
১. ক ২. খ ৩. গ ৪. গ ৫. ক ৬. ঘ ৭. ক ৮. ক ৯. খ ১০. গ ১১. খ
এইচএসসি রসায়ন ১ম পত্র স্পেশাল সাজেশন ২০২৫, hsc Chemistry 1st Paper suggestion 2025










প্রশ্ন ও মতামত জানাতে পারেন আমাদের কে ইমেল : info@banglanewsexpress.com
আমরা আছি নিচের সামাজিক মাধ্যম গুলোতে ও







